Nous avons déjà largement
évoqué la source minérale de Nonhigny, soit dans l'article
« Lombrigny ? », qui montre
l'erreur de nom recopiée pendant près de 80 ans dans les
ouvrages traitant des eaux minérales, soit dans l'article
« Muschelkalk, source de Nonhigny », qui en 1880 espère que « Peut-être, dans quelques années,
verrons-nous à Nonhigny des établissements aussi florissants que
ceux de Contrexéville et Vittel. »
Rappelons aussi ce qu'en écrit Edmond Delorme en 1927 (Le
Canton de Blâmont) :
« On parle depuis longtemps, à titre, de curiosité, des
Fontaines d'Eau minérale que possède Nonhigny, Ces fontaines
donnent, en abondance, une eau ferrugineuse, qui colore en brun
les objets mis en contact avec elle. De vastes auges, où les
animaux viennent boire, recueillent l'eau de l'une de ces
fontaines et celle de l'autre est déversée dans un bassin de
marbre évidemment fort ancien. Les habitants du pays font grand
cas de ces eaux, qui mériteraient d'être plus connues et d'être
sérieusement étudiées, ainsi que le terrain qui les fournit.
Guerrier, Grosse, l'Abbé Gérard, curé de Nonhigny, auteur d'une
Étude des Eaux de la Lorraine et de l'Alsace, ont attiré
l'attention sur les eaux minérales de celle localité. »
Le bassin de marbre (« dont le travail remonte à un temps
inconnu » selon E. Grosse, et dont « La tradition en fait
remonter la construction jusqu'aux Templiers » selon H.
Lepage), n'existe plus ; on aurait pu croire que la source recaptée récemment,
et qui arrive au centre même du village dans un bassin à double alimentation
(dont l'eau de ville - voir photographie en
bas de cette page), était la source minérale tant évoquée.
| D'autant que cette source minérale a
donné ses armes à la commune de Nonhigny «
De gueules à une fontaine d'or jaillissante d'argent
soutenue par deux saumons adossés d'argent. », où
s'adjoint donc aux saumons des comtes de Blâmont, la
fontaine caractéristique de Nonhigny. |
 |
Car il restait à connaître les
composantes chimiques de cette eau qui a pour caractéristique
de « colorer en brun les objets mis en contact avec elle »
: or la source récemment recaptée ne possède pas une telle
propriété. Une
étude de la préfecture de Meurthe-et-Moselle publiée en 1879 (et
sans doute source de la conférence précitée de 1880) nous
apporte des informations chimiques complémentaires :
DESCRIPTION DES TERRAINS
QUI CONSTITUENT LE SOL DU DEPARTEMENT DE MEURTHE-ET-MOSELLE
M. A. BRACONNIER
Préfecture de Meurthe-et- Moselle
1879
§ 224. Source sulfatée
calcique de Nonhigny.
Près des maisons du village de Nonhigny, l'on observe une source
minérale débitant de 6 à 7 litres par minute et présentant, en
raison de la couleur rouge de ses dépôts et de son odeur
d'hydrogène sulfuré, tous les caractères de l'eau minérale
sulfatée calcique des sources des Vosges. L'analyse chimique
confirme en effet cette identité ; on trouvera dans le tableau
ci-dessous la composition, en milligrammes, par litre, de l'eau
de Nonhigny (107), de l'eau du Pavillon à Contrexéville (108),
de l'eau de la source d'Heucheloup (109), de l'eau de la source
n°1 à Martigny (110) ; les lettres ont la même signification
qu'au § 209.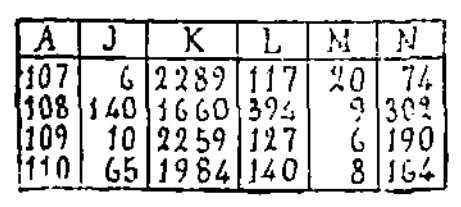
[ § 209 [...] Le tableau
ci-contre, dans lequel A désigne le numéro d'ordre, B la silice,
J le chlorure de sodium, K le sulfate de chaux, L le carbonate
de chaux, M le carbonate de fer et N le carbonate de magnésie,
donne la composition en milligrammes par litre, [...], d'où
le tableau :
|
Mg/l |
chlorure de sodium |
sulfate de chaux |
carbonate de chaux |
carbonate de fer |
carbonate de magnésie |
|
Nonhigny |
6 |
2289 |
117 |
20 |
74 |
|
Contréxéville
(Pavillon) |
140 |
1660 |
394 |
9 |
302 |
|
Heucheloup |
10 |
2259 |
127 |
6 |
109 |
|
Martigny n° 1 |
65 |
1984 |
140 |
8 |
164 |
]
Il y aurait grand intérêt à capter cette source minérale qui
pourrait rendre de grands services ; le captage, en réunissant
les filets qui se perdent près de la surface, porterait, sans
doute, le débit par minute à plus de 15 litres. Le voisinage des
vallées pittoresques du grès vosgien donnerait un grand attrait
à une station de bains créée à Nonhigny.
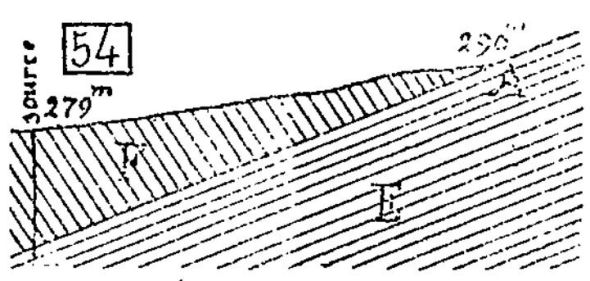
La formation de cette source s'explique ainsi qu'il suit (fig.
54). Les eaux de pluie s'infiltrent en A, à la cote 290 mètres,
au contact des grès dolomitiques de la partie supérieure du grès
bigarré et des marnes bariolées gypseuses de la base de l'étage
F ; elles descendent dans cette zône, sous les argiles
imperméables de cet étage F jusqu'à Nonhigny où elles
rencontrent une cassure qui leur permet de remonter au jour à la
cote 279 mètres. Dans leur trajet souterrain, elles se saturent
de sulfate de chaux, carbonate de chaux, de magnésie et de fer,
toutes substances abondantes dans la zone qu'elles ont suivie.
Plus loin dans l'ouvrage, au
chapitre « Calcaires de Blâmont et Moyen. Calcaires du
Muschelkalk » l'auteur nous donne les caractéristiques
équivalentes des sources Blâmont et Repaix :
« Le tableau ci-dessous, où les lettres ont la même
signification qu'au § 209, donne la composition des sources
suivantes : 155, sources de Repaix ; 156, id. de Blâmont ; 157
id. d'Azerailles ; 158, id. de Glonville; 159, id. de Magnières.
»
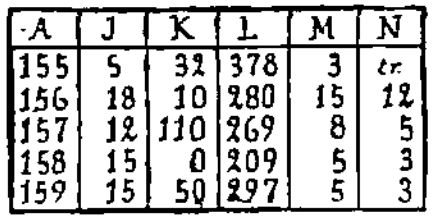
On peut donc dresser le
tableau comparatif entre les eaux de la source minérale de
Nonhigny, et les sources d'eau potable de Repaix-Blâmont :
|
Mg/l |
chlorure de sodium |
sulfate de chaux |
carbonate de chaux |
carbonate de fer |
carbonate de magnésie |
|
Nonhigny |
6 |
2289 |
117 |
20 |
74 |
|
Repaix |
5 |
32 |
378 |
3 |
traces |
|
Blâmont |
18 |
10 |
280 |
15 |
12 |
|
Mais pourquoi cette
eau de Nonhigny
« colore en
brun les objets mis en contact avec elle » ?
La particularité que
l'on rencontre à Nonhigny dans les tableaux ci-dessus,
est une importante présence à la fois de sulfate de
chaux et de carbonate de fer (le carbonate de fer est
moins présent à Contrexeville, et le sulfate de
chaux quasi absent à Blâmont).
Nous allons tenter
une explication chimique, en priant les lecteurs plus
avisés de ce sujet de nous apporter toute correction
nécessaire.
- On a donc
- Carbonate de fer : FeCO3
et
- Sulfate de chaux (de calcium en réalité) : CaSO4
- Dans l'eau, le sulfate de
chaux devient de la chaux éteinte, Ca(OH)2
:
CaSO4 + 2 H2O = Ca(OH)2
+ H2SO4
(l'acide sulfurique H2SO4
explique l'«
odeur
d'hydrogène sulfuré »)
- L'addition de la chaux
éteinte au carbonate de fer donne de l'hydroxyde de
fer II, Fe(OH)2 :
FeCO3 + Ca(OH)2 = Fe(OH)2
+ CaCO3
(la présence de ce carbonate de
calcium CaCO3,
participe sans doute à enrober les objets d'une
couche de calcite...)
- et sous l'action quasi
instantanée de l'air, l'hydroxyde de fer II s'oxyde
en hydroxyde de fer III, Fe(OH)3 :
4 Fe(OH)2 + 2 H2O + O2
= 4 Fe(OH)3
- Puis cet hydroxyde de fer III
se transforme en oxyde de fer III hydraté, Fe2O3
:
2 Fe(OH)3 = Fe2O3 +
3 H2O
- Et cet oxyde de fer III
hydraté, Fe2O3 est... de la
rouille ! qui complète et colore la couche de
calcite déposée sur les objets.
|
|















